摘要
背景
育雏寄生虫可以对寄主施加强大的选择压力。许多育雏寄生虫通过模仿宿主的感官线索来逃避它们的探测。然而,几乎没有证据表明宿主是否能够通过改变这些线索来逃脱寄生虫的模仿。我们通过分析表层碳氢化合物(CHC)剖面来解决这一问题Cerceris而且Philanthus黄蜂和它们的幼虫,杜鹃黄蜂模仿宿主的CHC谱。这些宿主中的一些使用碳氢化合物来保护它们的猎物免受真菌侵袭,因此,它们不能显著改变它们的CHC组成,以响应化学拟态Hedychrum育寄生虫。
结果
我们发现,在寄主黄蜂不保存猎物的情况下,巢内寄生虫与寄主之间的CHC重叠比保存猎物的寄主黄蜂低,后者的CHC进化受到限制。此外,在未保存的寄主黄蜂中,雌性的CHC分布比雄性更加多样化,因此在雌性中被巢内寄生虫化学模拟。
结论
我们的研究结果为那些从化学模板上的稳定选择中解放出来的宿主和它们的寄生虫之间的化学军备竞赛提供了证据。
简介
相互作用的物种之间的共同进化被认为是产生生物多样性的主要力量之一[1].共同进化在群落的组织中起着重要的作用,例如,通过塑造共生和寄生的相互作用,以及自由生活类群之间的相互专业化[2,3.],以及推动主要创新成果的出现[4,5].然而,要证明一种特定的特征是对来自不同物种的另一种特征的反应而进化出来的,而进化出来的特征反过来又引起了反适应,这并不简单。要排除外部选择压力对某一特定特征的影响尤其困难。6].
在拮抗相互作用中,种间窝寄生是窃寄生蜂和拟寄生蜂(后来统称为窝寄生)的普遍策略。育雏寄生虫利用宿主为后代提供的食物(盗窃寄生虫)或宿主后代本身的未成熟阶段(拟寄生蜂)来抚养自己的后代[6,7,8,9].关于巢寄生物和寄主之间的共同进化,研究得最好的例子之一是杜鹃和寄主之间的共同进化。在这里,布谷鸟的宿主进化出各种策略来破坏布谷鸟对宿主卵的光学模仿,例如增加卵的颜色多态性[6,10].对于这种对立的共同进化关系,范·瓦伦的红皇后假说提供了一个理论框架,解释了宿主和它们的寄生虫之间的进化军备竞赛[11].
嗅觉交流对昆虫来说至关重要[12].由于几乎所有昆虫都被角质层碳氢化合物(CHCs)覆盖,这种多样化的符号化学物质在传递重要信息方面具有特别的重要性,如物种身份、年龄、性别、生殖状况,以及在社会性物种中,种姓和群体成员[13].因此,一些育雏寄生昆虫进化出用化学方法欺骗宿主以掩盖其有害行为的能力也就不足为奇了。
众所周知,昆虫幼虫至少采用三种不同策略中的一种来成功欺骗寄主的嗅觉识别系统[14]:(1)育窝寄生虫在其角质层上合成的碳氢化合物总量很低和/或简单的混合物,因此很少向宿主提供识别线索[15,16,17];这叫做化学不重要策略。(2)巢内寄生虫通过梳理,在物理上采用宿主的CHC特征;这种策略被称为化学伪装[18,19].(3)育雏寄生虫重新合成与其宿主非常相似的CHC谱[14];这种策略被称为化学模仿.这三种策略并不是相互排斥的,一些育雏寄生虫同时使用它们。例如,蝴蝶Phengaris (Maculinea) rebeli,其幼虫在蚁巢中发育,会同时运用化学模仿和化学伪装策略来欺骗宿主[20.].
宿主可以通过进化出一种更好的识别和区分化学线索的能力和/或通过表达与它们的巢寄生物不同的化学表型来抵消它们的巢寄生物的化学欺骗策略(如。,通过负频率依赖选择;[21,22].然而,到目前为止,宿主对其巢内寄生虫化学模仿的进化反应受到的关注相对较少。
尽管化学拟态对昆虫巢居寄生虫很重要,但很少有研究提供证据证明这种策略会导致巢居寄生虫与其宿主之间的共同进化军备竞赛。例如制造奴隶的蚂蚁[23,24,25],大黄蜂[26],黄蜂[27]、杜鹃黄蜂及其寄主[21,28].在大多数研究案例中,寄生种采用化学伪装策略(即。例如蚂蚁、大黄蜂、黄蜂),通常与不重要策略有关。此外,这些病例中的大多数涉及系统发育密切相关的宿主-巢内寄生虫物种对,这种现象被称为Emery规则[29].化学拟态的明确证据目前仅从亲缘关系较远的寄主-雏虫物种对中得知。在这里,育雏寄生虫被迫进化出与宿主相匹配的化学特征[20.,21].
为了阐明寄主-巢寄生物种对的化学适应,我们研究了不同物种间CHC谱的共同进化模式,使用了该属的杜鹃黄蜂Hedychrum(膜翅目:叶蜂科:叶蜂属)和它们的远亲宿主,该属的无头黄蜂Cerceris而且Philanthus(膜翅目:蜂科)[30.,31,32,33],作为模特。女性的Cerceris而且Philanthus这些物种在地下挖掘孵化细胞,并为它们的幼虫提供瘫痪的猎物,这些猎物要么是甲虫(鞘翅目黄蜂:COLw),要么是刺黄蜂和蜜蜂(膜翅目黄蜂:HYMw)。
是什么让上面提到的主持人Hedychrum特别有趣的是,已知HYMw(而不是COLw)的雌性杜鹃黄蜂会用咽后腺的分泌物对猎物进行防腐,以延缓/防止猎物受到真菌侵袭[34,35,36,37].这些分泌物主要由不饱和长链碳氢化合物组成(如。,烯烃),会在猎物身上形成一层疏水油层,防止水凝结,并损害猎物身上的霉菌发育[38,39].此外,雌性HYMw咽后腺的碳氢化合物成分与黄蜂自身角质层的CHC成分非常匹配[40],与之前在蚂蚁身上观察到的相似[41].由于不同物种咽后腺CHC成分高度相似,其特定成分可能代表了一种保护猎物的适应,因此该成分可能处于稳定选择状态[37].相比之下,COLw的雌性不会用CHCs分泌物来保存它们的猎物,因为它们的猎物不太容易受到真菌生长的影响[37].因此,HYMw的雌性不能在不失去保护猎物的能力的情况下改变它们的CHC特征。相比之下,COLw的雌性似乎不受CHC谱上稳定选择的限制,因此有能力改变CHC谱以避免其巢内寄生虫的化学模仿[37].
在本研究中,我们报告了测试三个假设的结果:(1)与HYMw的巢寄生物相比,COLw的巢寄生物杜鹃的CHC谱拟态更不精确,因为COLw比HYMw有更多的能力改变它们的CHC谱以响应化学拟态。(2)只有雌性杜鹃黄蜂采用化学模仿策略,因为只有雌性杜鹃黄蜂才受益于不会在宿主巢中留下可探测到的入侵痕迹。(3)寄主可能的化学反适应主要影响雌鸟,因为雌鸟的巢受到杜鹃黄蜂的入侵。这是因为只有雌性宿主在选择性寄生虫压力下进化出对杜鹃黄蜂化学模仿的反适应。为了更好地解释宿主和寄生虫CHC谱中可能的适应和反适应,我们通过推断该属的系统发育来考虑被调查物种的系统发育历史Hedychrum考虑到已发表的宿主系统发育树。
结果
分子系统发育和进化关系
我们推断的杜鹃黄蜂系统发育表明,该物种寄生于COLw (Hedychrum chalybaeum,Hedychrum niemelai,Hedychrum高贵的)和寄生在HYMw (Hedychrum gerstaeckeri,Hedychrum longicolle,Hedychrum rutilans)每一种都形成一个自然的群体。相比之下,以膜翅目为捕食对象的寄主物种,相对于以鞘翅目为捕食对象的寄主物种而言,是对翅类[37(图。1).
一个所分析的宿主的系统发育关系(左,改编自戴克等., 2017)和它们的窝寄生虫(右)。图片显示一只雌性Cerceris arenaria与象鼻虫猎物(左上)在一起的是一只雌性象鼻虫Philanthus三角座左下是一只雌性蜜蜂,它的猎物是蜜蜂Hedychrum高贵的在c . arenaria筑巢地点(右上)和一只雌性Hedychrum rutilans在p .三角座筑巢地点(右下)。B寄主雌性个体(左)和母巢寄生虫(右)的代表色谱图。系统发育树采用最大似然最优准则进行推断。引导支持值在每个节点之上给出。除了外群物种(灰色部分)外,寄主与巢窝的寄生虫关系(Stizoidessp.和Bembixsp。Hedychridiumspp)和Hedychrum longicolle
角质层油气剖面组成
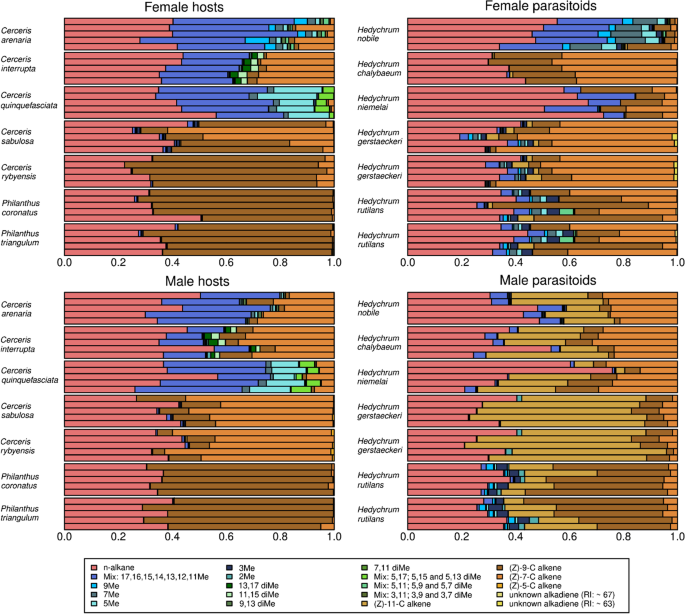
总的来说,我们在12个物种(宿主和雏虫)的两性中鉴定出112种不同的CHCs (N = 277;额外的文件2:表S4,S5)。在112个CHCs中,12个是直链烷烃,30个是烯烃,9个是醇二烯,39个是单甲基支链烷烃,22个是二甲基支链烷烃。线性烷烃占各物种CHC总量的30-45%(雌性除外)h . niemelai其中烷烃占CHC总量的64%)。不饱和化合物在膜翅虫猎蜂/宿主(HYMw)的CHC中占65%,而甲基支链烷烃在HYMw中的比例不到总CHCs的3%(表2)1).我们在任何HYMw中都没有发现二甲基支链烷烃。相比之下,甲基支链烷烃的范围从20%(男性的Cerceris interrupta)到COLw的CHC剖面的60%以上(图。2).
雌性HYMw的CHC谱在物种间非常相似,主要由烯烃(60-65%)和线性烷烃(34-37%)组成。HYMw物种的雄性在CHC物质类组成上与雌性同类相似(图2)。2),但它们在系统上不同于同类型的雌性,因为它们的烯烃相对丰度较高,这些烯烃的双键位置与雌性的烯烃不同。相比之下,COLw的雌性和雄性烯烃的组成差异更大(雌性和雄性分别为0-30%和8-38%),甲基支链烷烃的组成差异更大(雌性和雄性分别为31-61%和20-55%)。COLw的雌性在CHC图谱中甲基支链烷烃的比例高于同卵雄性(50% vs. 38%, t(54) = 3.03,p= 0.049;表格3.;额外的文件1:图S1c)。总体而言,女性和男性HYMw的CHC谱差异较小(女性和男性的CHC谱差异分别为24.7±3.49和21.9±4.46),而女性和男性COLw的CHC谱差异较小(女性和男性的CHC谱差异分别为30.0±6.17和34.5±3.65)。HYMw中化合物的数量比COLw中要少,这是由于HYMw表达的甲基分支化合物数量非常少(平均少于6种化合物,附加文件2:表S4,S5)。在COLw中,只有Cerceris arenaria女性CHC谱中化合物含量高于男性(女性为35.9±1.13,男性为31±1.26);t(17) = 8.8427,p< 0.001)。在其他两个COLw物种中(即。,Cerceris interrupta而且Cerceris quinquefasciata),男性在其CHC图谱中拥有的CHC化合物数量要多于同卵女性(表2)3.;额外的文件1:图S1a,b)。
杜鹃黄蜂的剖面包含在其宿主中发现的所有CHC物质类。与COLw相比,寄生在HYMw的物种具有更大比例的烯烃(t(108) =−4.99,p< 0.001)。寄生COLw的物种比寄生HYMw的物种表现出更大比例的甲基支链烷烃h . chalybaeum(t(88) =−2.88,p= 0.059)。后者表现出更大比例的烯烃(> 60%的CHC剖面)类似于Hedychrum寄生于HYMw的种。COLw的雌性幼虫产生大量的甲基支链烷烃(14-48%),除了h . chalybaeum(< 0.5%),而同卵雄性产生较高的烯烃相对量(51-62%),其比例与HYMw雌性和雄性窝寄生虫中烯烃的比例相似(图2)。2和表1).HYMw雌虫和雄虫在合成烯烃类型上存在差异:雌虫主要合成7号和9号双键烯烃,同卵雄虫主要合成9号和11号双键烯烃。
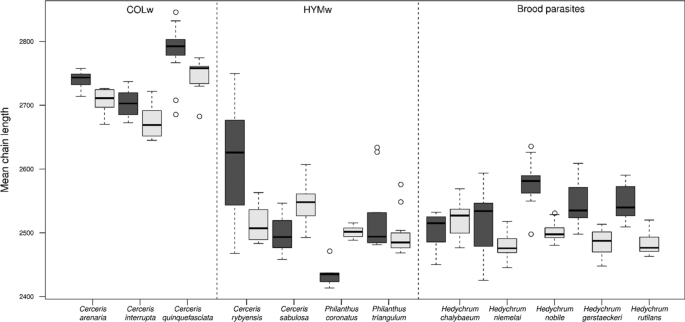
在COLw中,男女的平均CHC链长度大约比HYMw和所有被研究的巢寄生物长两个碳原子(图2)。3.).与HYMw相比,COLw物种的雌性和雄性合成链长小于24个碳原子的碳氢化合物的相对数量显著减少(t(97) =−16.7,p< 0.001)。一般来说,宿主和寄生虫的雌性合成的CHCs的平均链长比雄性长(t(259) = 3.58,p= 0.007)。当分别调查不同的行当(COLw, HYMw和育雏寄生虫)时,比较COLw宿主的雄性和雌性时发现了这种模式(t(54) = 3.23,p(t(96) = 7.99);p< 0.001)。在HYMw (t(50) = 1.47,p= 0.7)。
育雏寄生虫和宿主的化学特征重叠
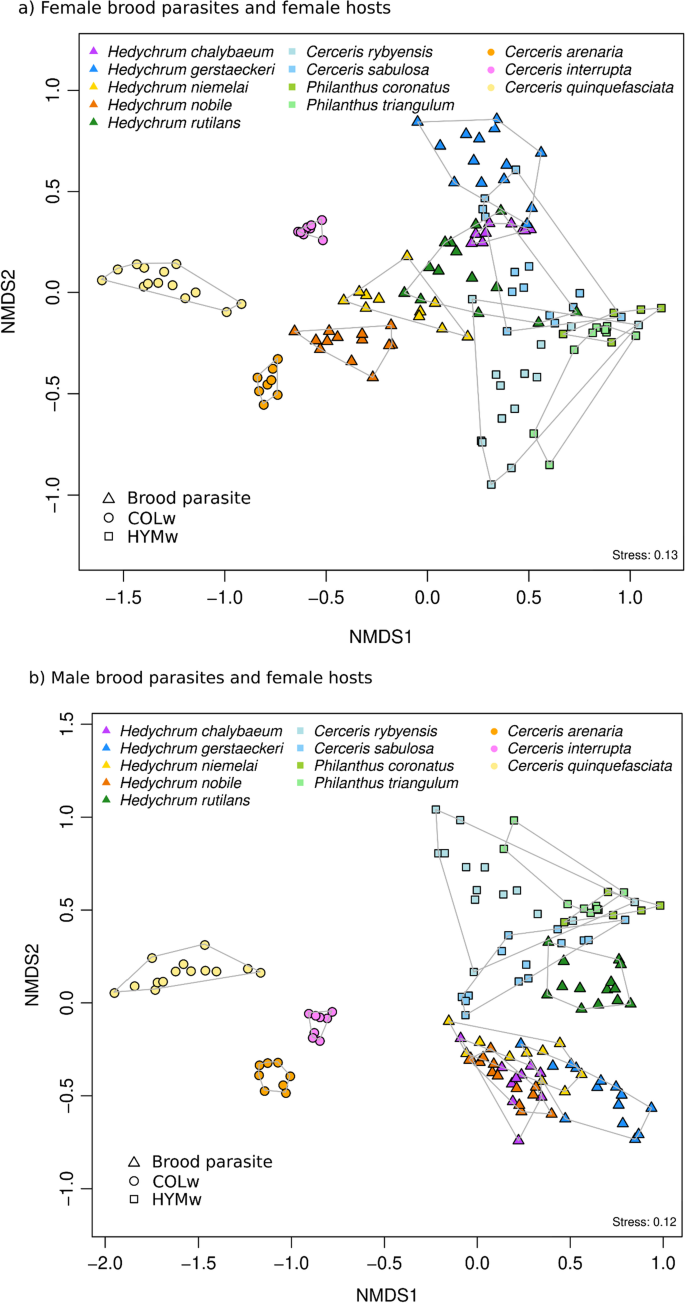
根据CHC剖面数据,NMDS揭示了COLw和HYMw的明显分离,两种宿主类型形成了不同的组,其化学空间几乎没有重叠(图2)。4a, ANOSIM R: 0.943,组内平均秩距:685,组间平均秩距:1890,p= 0.0029, 9999个排列)。这种分离主要是由于两类寄主中甲基支化化合物和不饱和化合物相对数量的差异(即。, COLw和HYMw)。Hedychrum高贵的还有——在较小程度上——h . niemelai产生大量的甲基分支化合物,因此通过占据宿主和HYMw之间的化学空间而与其他杜鹃黄蜂分离。相比之下,所有HYMw及其巢寄生物所占的化学空间范围相对较小,且化学特征重叠(即。时,它们彼此非常相似,图。4a). R值接近或等于1表示组间没有重叠。事实上,在所有colw -育雏寄生虫的比较中,ANOSIM的R统计量都大于0.99,而在HYMw及其育雏寄生虫的比较中,它的R统计量在0.66 - 0.93之间。当将雄性幼虫的CHC图谱与雌性寄主的CHC图谱绘制在一起时,观察到了一种不同的模式:寄生于COLw物种的雄性杜鹃黄蜂彼此之间的化学成分相似,并与COLw寄主分离(图2)。4b, colhost雄性育雏寄生虫的ANOSIM, R: 0.4873;p= 0.0029;COLw雄寄主与雌性寄主间的ANOSIM, R: 1,p= 0.0029),而COLw的雌性育雏寄生虫彼此之间差异很大(ANOSIM R: 0.9686,p= 0.0029)。除了h . rutilans(COLw和HYMw雌性幼雏寄生物间的ANOSIM, R: 0.4524,p= 0.0029;COLw雄虫与HYMw雄虫间的ANOSIM, R: 0.7184;p= 0.0029)。雌寄生蜂与雌寄生蜂的重叠量大于雌寄生蜂与雄寄生蜂的重叠量(雌寄生蜂与雌寄生蜂的ANOSIM, R: 0.5873,p= 0.0029;雌性寄主与雄性育雏寄生虫间的ANOSIM, R: 0.9349;p= 0.0029)。但在分析HYMw时,雌性HYMw巢寄生物与雌性宿主的化学空间重叠与雄性HYMw巢寄生物与雌性宿主的化学空间重叠相似(雌性HYMw巢寄生物与雌性巢寄生物间的ANOSIM, R: 0.4297,p= 0.0029;雌性HYMw寄主与雄性幼虫间的ANOSIM, R: 0.4651,p= 0.0029)。
基于非度量多维尺度的研究种CHC剖面的分离。鞘翅目猎人(COLw)用圆圈表示,膜翅目猎人(HYMw)用正方形表示,育雏寄生虫用三角形表示。类似的色相颜色用于表示主机-育雏寄生虫种类对:橙(Cerceris arenaria/Hedychrum高贵的)、紫色(c . interrupta/h . chalybaeum)、黄色(c . quinquefasciata/h . niemelai)、绿色(Philanthus coronatus而且p .三角座/h . rutilans)、蓝色(c . rybyensis而且c . sabulosa/h . gerstaeckeri).一个雌性寄生虫和它们的雌性寄主b雄性寄生虫和它们的雌性寄主
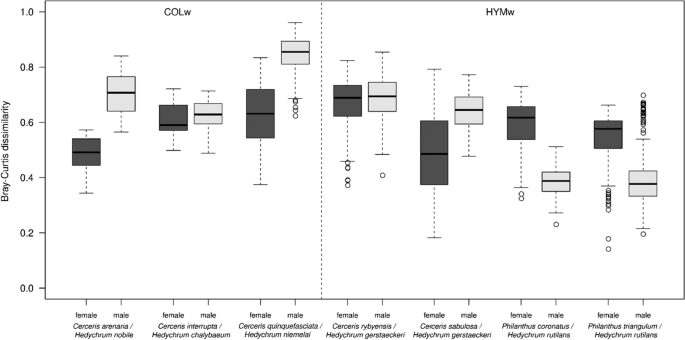
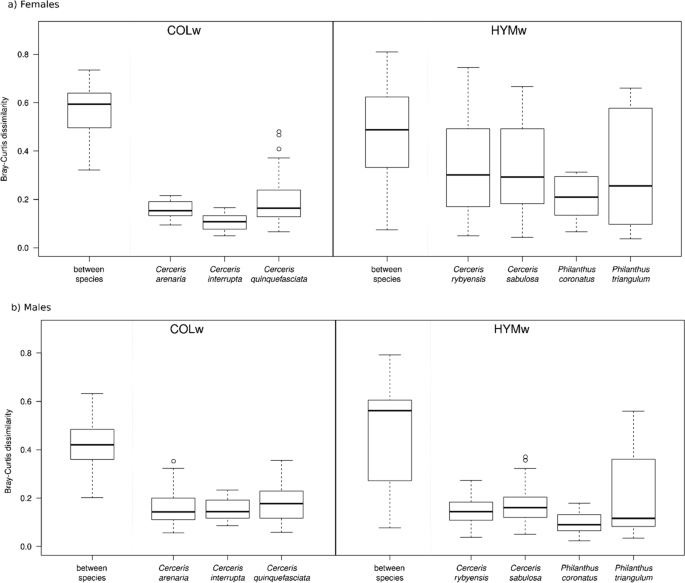
雌性宿主/雌性幼虫幼虫化学距离几乎总是小于雌性宿主/雄性幼虫幼虫化学距离(计算所有化合物的布雷-柯蒂斯不相似指数)。两者之间的比较是例外Philanthus物种和h . rutilans(无花果。5).我们没有发现雌性HYMw宿主与雌性幼虫的化学距离和雌性COLw宿主与雌性寄生虫的化学距离之间的差异(t(820) =−1.36,p= 0.77)。COLw雌性寄主与雌性幼虫的化学距离小于雄性幼虫的化学距离(0.58 vs. 0.68, t(643) =−10,p< 0.001)。然而,HYMw雌寄主与雌寄主的化学距离与雄寄主的化学距离相似(0.57 vs. 0.58;t(1191) = 1.84,p= 0.5)(图5).
HYMw和COLw宿主的种内和种间CHC变异
我们观察到一种模式,表明在NMDS图中CHC谱的种间和种内变异的差异。4a).为了进一步评估这种模式,我们计算了物种之间和物种内部的Bray-Curtis差异。COLw宿主的种间差异显著大于HYMw宿主的种间差异(平均0.57±0.09 vs. 0.47±0.17;Bray-Curtis距离;T(897) =−11.39,p< 0.001)。相比之下,COLw宿主雌性间的种内变异要小于HYMw宿主雌性间的种内变异(平均而言,COLw种内样本间的Bray Curtis距离为0.17±0.08;HYMw种内平均为0.32±0.19;t(334) = 10.83,p< 0.001)。因此,与COLw寄主物种的雌性相比,HYMw寄主物种的雌性表现出更大的种内剖面方差,从而在同一物种的个体之间表现出更大的差异。在同卵男性中未观察到这一趋势。6).COLw和HYMw的雄性相对于同种雌性表现出较小的种内变异。为了测试这些结果是否不是物种间样本量差异的人为因素,我们只使用每个物种的五个样本(所有被分析物种一致可用的最大样本数量)重复分析,并获得了可比的结果(见附加文件)1:图S2)。此外,我们分析了随机选取的两个HYMw宿主物种的雌性和两个COLw宿主物种的雌性CHC谱,每对样本都来自同一种群(同一物种和同一采集地点)。我们发现HYMw雌性的种内差异显著大于COLw雌性[t(1324) = 22.2,p< 0.001)。相比之下,当使用两名HYMw男性和两名COLw男性的CHC谱重复分析时,没有观察到这种差异(见附加文件)1:图S3)。
讨论
我们的研究结果证实了COLw和HYMw之间存在明显的CHC剖面组成差异,这是Wurdack及其同事首先提出的[37].HYMw物种表现出主要由不饱和化合物组成的特征,并且彼此之间比COLw物种更相似。相比之下,COLw物种具有含有大量单支链烷烃和二甲基支链烷烃的CHC分布,这些化合物也占CHC总量的很大一部分。由于其生物合成途径的遗传基础,所有被调查物种的CHC谱的组成都是种特异性和性别特异性的,可遗传[13,42].虽然我们知道某些物种的CHC剖面具有可塑性,但我们可以在很大程度上排除可塑性作为CHC差异的解释,因为我们收集了来自同一地区、环境条件非常相似的所有个体。
CHC在COLw中的多样化导致COLw与其巢寄生物之间的化学重叠较少
我们的第一个假设是,COLw种的育雏寄生虫在化学上不如HYMw种的育雏寄生虫精确地模仿宿主的CHC特征。这是因为COLw可以在很大程度上改变它们的CHC剖面,因为它由于放弃猎物防腐而受到的限制较小,而HYMw似乎根本不能显著改变它们的CHC组成,后者因此代表了一个容易的化学模拟目标。因此,HYMw的巢内寄生虫的CHC剖面组成应该与宿主的CHC剖面组成有很强的重叠,因为HYMw被限制产生相对固定的、富含烯烃的CHC剖面,以应对猎物的防腐。放弃猎物的防腐行为,根据[37]可能是后来在COLw中进化而来的,可能是通过稳定选择的松弛使COLw免于产生富含烯烃的CHC剖面。
我们发现COLw寄主与HYMw寄主在许多特征上存在差异,所有这些都可以归因于杜鹃黄蜂对逃避拟态的适应:(a)生物合成了更多数量和更高数量的甲基支化CHC, (b)产生了高链长CHC化合物,减少了短链长化合物,以及(c)与HYMw寄主相比CHC谱的种内变异较小(图3)。6a).此外,COLw中观察到的种间高度不相似可能是为了避免CHC分布与其寄生虫重叠而产生的,但COLw中种间差异较大(图2)。6a)避免CHC图谱与其寄生虫重叠。正如预期的那样,HYMw和它们的雌性育雏寄生虫之间有较大的CHC谱重叠,而COLw和它们的雌性育雏寄生虫之间没有CHC谱重叠。然而,与我们的预期相反的是,HYMw与其巢内寄生虫之间的Bray-Curtis差异并不比COLw雌性宿主与其巢内寄生虫之间的差异小。
HYMw的雌性母巢寄生虫产生与其宿主数量相同的化合物类[21].然而,宿主和育雏寄生物中烯烃双键位置的差异导致雌性HYMw与其雌性育雏寄生物之间的CHC谱之间存在较大的化学距离,这可以解释为HYMw用于逃避化学拟态的一种策略。此外,HYMw雌巢寄生虫CHC谱(即。,h . gerstaeckeri而且h . rutilans)含有少量(~ 5%)的化合物(如。甲基分支化合物),它们在宿主的CHC剖面中不存在,这有助于在雌性HYMw和雌性育仔寄生虫之间观察到相对较大的化学距离。然而,在HYMw窝寄生虫的角质层上以低丰度出现的CHC化合物是否能被宿主识别是未知的,特别是考虑到这些线索可能会干扰环境的气味(如.,筑巢材料,猎物物品提供)。
有趣的是,尽管COLw宿主及其相关的育雏寄生虫的CHC谱在化学空间上没有重叠,但COLw宿主的雌性育雏寄生虫(除了h . chalybaeum)通常会产生与其宿主相同的甲基分支化合物(或者至少是具有相同分支位置的甲基分支化合物)。寄主和巢寄主之间甲基分支化合物的相似性是COLw寄主与其杜鹃黄蜂之间化学距离相对较短的主要原因。甲基分支化合物的CHC分布多样化可能是宿主选择的结果。事实上,一些研究表明,具有更多甲基支链烷烃的CHC分布在其他膜翅目昆虫的高度寄生种群中普遍存在:例如,被寄生的蚂蚁群落胶木fusca二甲基支链烷烃的多样性高于未被寄生的,这种化合物多样性的增加与宿主种群识别能力的提高有关[43].同样,纸黄蜂CHC剖面中甲基支化烃的比例Polistes biglumis大的群体会被社会寄生虫高度寄生吗Polistes atrimandibularis[44].
除了COLw中CHC分布的多样化外,我们还发现COLw中CHC的平均链长明显大于HYMw和所有被调查的巢内寄生虫。因此,COLw及其巢内寄生虫的平均链长存在差异,而HYMw及其巢内寄生虫的平均链长没有差异。多项研究表明,CHC剖面的链长变化可能是由于气候条件的变化(如。, (45,46,47])。然而,由于这两种类型的寄主居住在相似的栖息地(温暖/干燥条件),甚至在混合巢穴聚集中共存——至少在我们研究物种的地区——两组寄主之间CHC链长度的差异不太可能是对气候条件适应差异的结果。HYMw物种似乎更有可能需要特定链长的烯烃,因为这种链长允许在它们的猎物身上传播的分泌物中保持半流体结构,以防止真菌感染[39].因此,COLw中短链化合物的消除可能代表了另一种逃离化学拟态的策略,因为这增加了宿主和寄生虫CHC谱之间的定性差异。平均链长的变化可能是有益的,如果它允许宿主更好地区分其他相似的CHC谱,从而使它们能够检测潜在的育雏寄生虫的CHC谱与自己的CHC谱之间的差异。此外,CHC平均链长的增加可能不需要新的酶途径的进化[48].
如上所述,HYMw与其育雏寄生虫的CHC剖面相似性低于预期。我们假设HYMw宿主通过应用另一种逃避策略来抵消其巢内寄生虫的化学拟态。化学上,HYMw被限制在其CHCs中保持相同比例的烯烃,因为烯烃赋予猎物保存的优势。然而,HYMw的雌性CHC谱比COLw的雌性CHC谱具有更大的种内变异。在HYMw的情况下,负频率依赖的选择可能有利于罕见宿主化学型的存在。高度可变的CHC谱可能导致种群中的某些个体表现出可能无法被育雏寄生虫很好地模仿的化学型。类似的现象(即,在离合变异中增加)已在禽杜鹃的宿主中观察到[10]:一些杜鹃宿主物种的雌性已经进化出了产卵不同颜色的能力。有人认为,杜鹃的宿主与它们的巢内寄生虫进行进化军备竞赛时,会增加窝内变异(即但同时应保持窝内颜色变异较低[49从而使巢内寄生虫的模仿更加困难。在昆虫中也观察到化学信号在物种内变异增加的类似适应。例如,在种群变异中,不同CHCs的相对比例在高寄生种群中更高Polistes biglumis与非寄生种群相比,可能是因为稀有表型的负频率依赖选择[44].同样,当chc的Temnothorax longispinosus在有和没有制造奴隶的蚂蚁的种群中,蚂蚁在种群内部和种群之间进行了比较Protomognathus也,寄主蚁种的CHC分布在被寄生种群中变化较大[22].我们已经证明,来自同一人群的HYMw女性宿主的两个随机选择的CHC profiles比来自COLw宿主的两个随机选择的CHC更不相似(附加文件)1:图S3)。HYMw女性CHC的变化主要是定量的。例如,九分之二的女性Philanthus三角座在我们的分析中,产生的主要化合物是(Z)-9-C27:1,而在其余的个体中,(Z)-9-C25:1更丰富(见图)。4a).雌性中产生一种或另一种烯烃的这种多态变异p .三角座以前在同一人群中已经报道过[28,50].这将是有趣的测试假设,这种化学多态性是一种适应部分逃避化学拟态通过h . rutilans.
在COLw宿主中,CHC剖面的多样性在女性中比在男性中更为明显
我们假设COLw宿主的雌性比雄性对CHC谱的选择压力反应更强,因此表现出更大的CHC谱多样性。如果COLw物种能够进化出不同于其巢寄生物的CHC图谱,我们应该会看到这种模式在雌性身上比在雄性身上更明显,假设CHC图谱是性别特异性进化的。虽然所分析宿主的CHC谱没有表现出显著的性别特异性质的差异,无论我们是分析COLw还是HYMw,我们发现女性和男性的CHC谱在数量上存在差异。具体来说,COLw的雌性的特点是在角质层上拥有更大比例的甲基支链烷烃。在COLw物种中c . arenaria此外,雌性比同卵雄性合成更多的甲基分支化合物。雄性特有的甲基分支化合物有助于雄性COLw的CHC多样性c . interrupta而且c . quinquefasciata(附加文件1:图S1a,b)并不大量产生,在男性CHC总剖面中所占比例不到3%。总的来说,雄性和雌性之间的CHC剖面差异与雌性COLw宿主逃避其巢内寄生虫的化学拟态的想法一致。
寄生于COLw寄主的雌性杜鹃黄蜂的CHC特征与寄主的CHC特征更相似,而与同卵雄性杜鹃黄蜂的CHC特征更相似
我们假设只有布谷鸟黄蜂雌性被选中来模仿雌性宿主的CHC特征。相比之下,杜鹃黄蜂雄性不应该被选择来模仿雌性宿主的CHC特征,因为它们与宿主或宿主的巢穴缺乏互动。这种模式在COLw及其幼虫寄生虫中尤其明显,因为由于放弃了猎物的防腐行为,COLw不受选择而合成富含烯烃的CHC剖面[37].正如预测的那样,我们发现杜鹃黄蜂雌性寄生于COLw种(除了COLw种)h . chalybaeum)在很大程度上与它们的雌性COLw宿主合成相同类型的化合物(特别是相同的同源甲基支链烷烃系列)。相比之下,雄性杜鹃黄蜂,不管它们是从什么类型的宿主进化而来的(即。, COLw或HYMw),显示富烯烃CHC剖面,其组成与HYMw的CHC剖面相似。有趣的是,对宿主物种的系统发育研究证明,HYMw物种是COLw的祖先[37].因此,所有杜鹃黄蜂的雄性似乎仍然合成了一个更古老的CHC剖面,并且在进化上受到COLw中甲基分支碳氢化合物含量更高的转变的影响比杜鹃黄蜂的雌性小。
结论
巢寄生可以对寄主施加强大的选择压力,以提高其检测巢寄生的能力。反过来,巢内寄生虫的特性是反选择的,使它们不被宿主发现。从使用膜翅目到使用鞘翅目作为蜂科猎物的转变,使COLw从生产富含不饱和CHC的CHC剖面中解放出来,这是防腐和保存膜翅目猎物的必要条件。我们证明,这种松弛可能允许COLw物种进化出以甲基支链烷烃为主的独特的和物种特异性的CHC分布,作为一种策略,以逃避它们的化学模仿Hedychrum育寄生虫。一些证据与我们的结论一致:(1)COLw CHC谱与HYMw富含烯烃的CHC谱明显不同,并且在不同物种之间非常不同,具有物种特有的甲基支链烷烃类型;(2) COLw的CHC谱重叠小于HYMw,但CHC谱的Bray-Curtis差异并不显著小于COLw;(3)雌性杜鹃胡蜂的CHC谱与COLw寄主种相似(除了h . chalybaeum),而其男性同体的CHC剖面与宿主可能祖先的HYMw CHC剖面相似。此外,COLw种的CHC链长比HYMw和所有种都长Hedychrum物种,这可能构成一种额外的策略,以逃避化学拟态由他们的窝寄生虫。总之,观察到的模式表明,在COLw宿主物种中进化出了具有甲基支链烷烃的CHC分布的多样化,并且它们的杜鹃黄蜂在化学空间中“跟随”了它们的宿主,这与军备竞赛假说一致。此外,我们的数据表明,HYMw可能通过表现出比COLw更大的种内CHC剖面变异性来抵消杜鹃黄蜂的化学拟态。虽然我们在表型水平上提供了共同进化军备竞赛的证据,但未来的研究应该考虑在遗传水平上寻找这场军备竞赛的足迹。
方法
昆虫样本的采集和来源
我们研究了12种(属5种)黄蜂每种5-14个个体的CHC特征和性别Hedychrum,属中的五种Cerceris,以及属的两种Philanthus、表2).为了避免考虑来自过去经历过非常不同气候条件的种群的个体,我们在弗莱堡和Germersheim(150公里)之间的莱茵河谷上游收集了所有标本。这些样本是在多年的过程中收集的,因为一些物种被认为是罕见的或难以大量发现的(如.,Hedychrum chalybaeum).由于多年的采样可能会增加变异(与仅一年的采样相比),我们还有意在几年的时间里收集了更常见的物种。我们筛选了在不同采样地点和不同年份收集的样品之间CHC剖面组成的可能差异,但没有发现任何显著差异(数据未显示)。除了五个目标种Hedychrum(见上文),我们在本属中增加了一个种(即。,h . longicolle2011年采集于西班牙Almarail),其原因与本研究无关。所有样品均采用昆虫网采集,并使用ON进行参考收集和DNA条形码鉴定。每只黄蜂都被放在一个玻璃小瓶(1.5毫升)中,并被运送到实验室,在那里,标本被冷冻杀死。所有标本保存在- 20°C,直到提取其CHCs和(仅在一部分样品中)DNA。注意,CHCs是在任何分子工作之前提取的。我们研究的DNA样本的凭证标本存放在波恩的亚历山大·柯尼格动物研究博物馆或ON和TS的个人收藏中(附加文件)2:表S1)。种Hedychrum已知是非常特定于宿主的,目前已知的研究物种的宿主关联概述在表3..
化学分析
冷冻昆虫解冻约5分钟,随后将其浸泡在纯正己烷中(Merck, Darmstadt, Germany)以提取CHCs。10分钟后,将CHC提取物转移到另一个玻璃瓶中,用温和的CO流进行浓缩2直到残留大约80-100 μ L的溶剂。CHC提取物存储在−20°C,昆虫单独存储在100%乙醇中以保存其DNA。
使用HP 6890气相色谱仪(GC)、HP 5973质谱检测器(MS) (Hewlett Packard, Waldbronn, Germany)和Agilent 7890/5975 GC/MS系统对提取物进行分析。采用DB-5型熔融二氧化硅毛细管柱(30 m × 0.25 mm ID, df = 0.25µm)为毛细管柱,注入量为1µl,注入温度为300℃,注入时间为1 min2, J&W Scientific, Folsom, USA)。以氦气为载气,流量恒定为1 mL/min。我们采用了如下的温度程序:启动温度为60°C,升温5°C/min至300°C,在300°C等温10 min。设置70 eV的电离电压(源温度为230°C)用于电子电离获取质谱。离子质量为40-600单位。
为了确定烯烃的双键位置,将每个性别和物种的1-5个提取物(取决于CHC提取物的可用量)合并,并按照Carlson及其同事提供的方案用于二甲基二硫化物(DMDS)的衍生化[51].由于在CHC提取物中该类物质的含量较低,其双键位置仍未确定。根据保留指数对醇卡烯进行了表征。
利用AMDIS 2.71版(自动质谱反褶积和识别系统,http://chemdata.nist.gov/mass-spc/amdis/).AMDIS利用质谱相似性和保留指数来选择目标化合物。具体来说,我们首先创建了一个质谱库(其中包含600多个已识别的常见碳氢化合物的质谱及其保留指数)。我们使用了Carlson和同事的协议[52],其中描述了CHC的洗脱模式,以确认该库中鉴定的甲基支链烷烃。AMDIS使用的参数为:分量宽度= 22,邻峰相减= 2,分辨率=中,灵敏度=低,形状要求=中。
在确定CHC后,我们通过在C21-C33范围内的剖面中每个峰的总离子计数相对于CHC的总离子计数来计算它们的相对丰度。为了确保一种化合物出现在给定物种的大多数样品中,并且不代表CHC提取物浓度差异或GC/MS灵敏度的人为因素,我们设置了一个组内任何化合物的考虑阈值。如果该化合物出现在至少50%的所有标本(每个性别和物种)中,并且平均相对数量丰度至少为0.1%,则满足这一最低阈值要求。
我们估计了化合物的总数和每个化合物类的化合物数量(即,线性烷烃,不饱和化合物和甲基支链烷烃)。此外,我们通过计算C21到C33范围内每个峰的相对数量,并根据其保留指数加权,计算出给定CHC提取物中CHCs的平均链长。这个值表示保留指数,CHC配置文件相对数量的一半出现在这个指数上。
化学数据的统计分析
使用R version 3.02软件对CHC剖面进行比较,并使用多变量方法对差异进行可视化[53].我们使用Bray-Curtis不相似度进行了非度量多维标度(NMDS),以可视化二维图中的CHC剖面相似性[54,55].所有推断的应力值都低于0.15。我们使用相似度分析(ANOSIM;[56],一个非参数检验,操作在一个排序的不相似矩阵。得到的检验统计量R(−1 < R < 1)表示组间和组内的相似程度。R值接近1表示测试组之间完全分离,值接近零表示组之间更相似(重叠更大,分离更少)。R值为负值并不常见,也没有生物学意义。
我们使用韦尔奇修正t检验[57,58],比较COLw和HYMw及其巢寄生虫的各种性状。具体来说,我们比较了寄主和它们的幼虫之间的Bray-Curtis差异,CHC化合物的比例、数量和多样性,以及平均链长。ANOSIM试验和t检验的P值使用Holm-Bonferroni校正进行调整[59]来解释多重测试。
对于大多数分析,我们使用R包素食主义者[60].用于绘图的R包ade4[61),猿[62),flagme[63),phytools[64),而xcms[65].
分子过程
在CHC提取后,我们使用每个物种一个或两个个体的肌肉组织进行DNA提取(见下文)。
我们使用了一组退化寡核苷酸引物对[66]在杜鹃黄蜂中扩增12个单拷贝蛋白质编码核基因(与[67];额外的文件2:表S2)。聚合酶链反应(PCR)和双向直接Sanger测序遵循[67].
将正向和反向DNA链组装成contigs,并在geneous (version 6.1;[68].所有contigs均使用MAFFT version 7.123的LINS-i算法进行对齐[69].通过校准来自杜鹃黄蜂1KITE转录组的每个靶基因的参考DNA序列,人工注释了内含子和外显子区域Chrysis terminata以及在基因组DNA测序中识别典型剪接位点(即。,二核苷酸对GC-AG)(见[67].我们手动从内含子DNA序列中去除无信息的和排列不明确的位点。最后,我们将所有的外显子和内含子连接到一个超矩阵中,并定义了三个分区:(1)外显子的第1和第2密码子位置,(2)外显子的第3密码子位置,(3)内含子。
系统发育分析
我们推断了所研究的系统发育关系Hedychrum通过应用最大似然最优准则来确定物种。具体来说,我们首先使用Modelfinder为每个分区搜索最佳拟合替代模型[70在IQ-TREE(版本1.5.5;[71]),并应用修正后的赤池信息准则(AICc)进行模型之间的选择。附加文件中列出了特定于分区的替换模型2:表S3。选择的替代模型和经验推断的替代参数随后用于在IQ-TREE中推断系统发育树。统计分支支持度由1000个非参数自举重复估计。我们还使用MrBayes 3.1.2版本软件在贝叶斯框架下进行了系统发育分析[72,73].为此,我们在Modelfinder中重复了模型选择步骤,但将测试的模型限制为在MrBayes中实现的模型。我们开始了两次并行运行,都是随机的开始树,超过107一代又一代。我们每10年采样一次5生成并丢弃前10个6两代人都是旧的。我们使用所有运行中剩下的树来计算50%多数规则共识树。采用Tracer软件(1.6版;[74])。
推断…的系统发育关系Cerceris而且Philanthus物种,我们使用Wurdack和同事发表的系统发育[37]并将其修剪为本研究中分析的物种。
缩写
- CHC:
-
表皮碳氢化合物
- COLw:
-
Coleoptera-hunting黄蜂
- HYMw:
-
Hymenoptera-hunting黄蜂
- GC / MS:
-
气相色谱/质谱分析
参考文献
莱恩l。共同进化在生物多样性产生中的作用:空间发散的选择轨迹。中国机械工程学报,2009;30(2):457 - 457。
汤普森约。共同进化的过程。芝加哥:芝加哥大学出版社;1994.
汤普森约。生命的共同进化之网(美国自然学家协会主席演讲)。中国科学。2009;173:125-40。
汤普森约。共同进化的作用。科学。2012;335:410-1。
Meyer JR, Dobias DT, Weitz JS, Barrick JE, Quick RT, Lenski RE.噬菌体lambda关键创新进化的可重复性和偶然性。科学。2012;335:428-32。
Rothstein SI。共同进化的模型系统:禽类寄生。生态学报,1990;21:481-508。
Davies NB, Bourke AF, Brooke MD.杜鹃和寄生蚂蚁:种间寄生作为一种进化军备竞赛。树。1989; 4:274-8。
温弗里·r·杜鹃、燕八哥和持续的巢寄生。树。1999; 14:338-43。
Spottiswoode CN, Kilner RM, Davies NB。育寄生。在:Royle NJ, Smiseth PT, Kölliker M,编辑。父母养育方式的演变。牛津:牛津大学出版社;2012.p . 226 - 356。
Spottiswoode CN, Stevens M.如何逃避一种共同进化的育苗寄生虫:卵辨别与卵变异性作为宿主防御。Proc Roy Soc B. 2011; 278:3566-73。
一个新的进化法则。《进化理论》1973;1:1-30。
Roitberg BD,化学通讯。在:Córdoba-Aguilar A, González-Tokman D, González-Santoyo I,编辑。昆虫行为:从机制到生态和进化后果。牛津:牛津大学出版社;2018.145 - 57页。
Blomquist GJ, Bagnères A-G。昆虫碳氢化合物:生物学,生物化学和化学生态学。剑桥:剑桥大学出版社;2010.
李志强,李志强,李志强。蚂蚁的化学生态学与社会寄生研究。昆虫学报2001;46:573-99。
Lambardi D, Dani FR, Turillazzi S, Boomsma JJ。早期切叶蚁社会寄生虫的化学拟态。《社会生物学杂志》2007;61:843-51。
李文杰,张志刚,张志刚,等。寄生蜂角质层碳氢化合物含量及其隐蔽性研究。中国昆虫学报(自然科学版);2009;12:9-16。
波多利C,盖耶M,施米特tSphecodes杜鹃蜜蜂使用不重要的化学物质来入侵它们的群居光舌蜂宿主的巢?Apidologie。2020;51:147 - 62。
Dettorre P, Mondy N, Lenoir A, Errard C.融入人群:群居寄生虫利用一种灵活的化学特征融入宿主群体。Roy Proc Soc B. 2002;2002(269): 1911-8。
von Beeren C, Schulz S, Hashim R, Witte V.获得化学识别线索有助于融入蚂蚁社会。BMC生态,2011;11:30。
Akino T, Knapp JJ, Thomas JA, Elmes GW。蝴蝶的化学拟态和寄主特异性Maculinea rebeli它是桃云母蚁群中的一种群居寄生虫。Proc Roy Soc B. 1999; 266:1419-26。
吴戴克,李志刚,李志刚,李志刚,李志刚,黄志刚,黄志刚,黄志刚,黄志刚,黄志刚,黄志刚,黄志刚,黄志刚,黄志刚,黄志刚Odynerus spinipes及其可能的进化原因(膜翅目:黄蜂科,黄蜂科)。Proc Roy Soc B. 2015;282:20151777。
当奴隶蚂蚁存在时,蚂蚁识别线索的多样性更高。行为学学报,2016;27:304-11。
Brandt M, Heinze J, Schmitt T, Foitzik S.蚂蚁社会寄生虫和宿主之间的共同进化军备竞赛中的化学水平。中华生物医学杂志,2005;18:576-86。
李志刚,李志刚,李志刚,李志刚,李志刚。产奴蚁角质层碳氢化合物变异的研究进展Rossomyrmex minuchae以及它的宿主Proformica longiseta(膜翅目:蚁科)。Chemoecology。2006;16:235-40。
Guillem RM, Drijfhout F, Martin SJ。蚂蚁社会寄生虫的化学欺骗。Curr Zool. 2014; 60:62-75。
马丁SJ,卡拉瑟斯JM,威廉姆斯PH,德里霍夫FP。寄主特定的社会寄生虫(Psithyrus)表示大黄蜂的化学识别系统。化学学报。2010;36:855-63。
军备竞赛的结果:化学策略Polistes社会的寄生虫。Ann Zool Fenn. 2006;43:55 5 - 63。
Strohm E, Kroiss J, Herzner G, lauren - kehnen C, Boland W, Schreier P, Schmitt T.披着狼皮的杜鹃?化学拟态在一个专门的杜鹃黄蜂的欧洲蜂(膜翅目,金蜂科和蟹蜂科)。Front Zool. 2008;5:2。
金刚山C. Über在Ursprung der dulotischen,寄生和myrmekophilen Ameisen。生物学报,1909;29:52 - 62。
Peters RS, Krogmann L, Mayer C, Donath A, Gunkel S, Meusemann K, Kozlov A, Podsiadlowski L, Petersen M, Lanfear R, Diez PA, Heraty J, Kjer KM, Klopfstein S, Meier R, Polidori C, Schmitt T, Liu S, Zhou X, Wappler T, Rust J, Misof B, Niehuis O.膜翅目昆虫的进化史。《当代生物学》2017;27:10 - 8。
Sann M, Niehuis O, Peters RS, Mayer C, Kozlov A, Podsiadlowski L, Bank S, Meusemann K, Misof B, Bleidorn C, Ohl M. Apoidea的系统基因组分析对蜜蜂姐妹群有了新的认识。BMC进化生物学2018;18:1-15。
Sann M, Meusemann K, Niehuis O, Escalona HE, Mokrousov M, Ohl M, Pauli T, schmidegger C.利用附加类群和序列数据对类群的系统发育进行了重新分析,确认了Ammoplanidae为蜜蜂的姐妹。昆虫学报。2021;46:558-69。
Pauli T, Meusemann K, Kukowka S, Sann M, Donath A, Mayer C, Oeyen JP, Ballesteros Y, Berg A, van den Berghe E, Escalona HE, Guglielmino A, Niehuis M, Olmi M, Podsiadlowski L, Polidori C, de Rond J, Rosa P, Schmitt T, Strumia F, Wurdack M, Liu S, Zhou X, Misof B, Peters RS, Niehuis O.对杜鹃胡蜂(膜翅目:黄蜂科)的RNA-seq、DNA目标富集和Sanger核苷酸序列数据的分析解决了系统发育中的深度分裂。昆虫系统Div. 2021; 5:1-14。
斯特罗姆E,林森梅尔KE。雌性欧洲蜂狼会保护它们的猎物免受真菌的竞争。昆虫学报2001;26:198-203。
Herzner G, Kaltenpoth M, Poettinger T, Weiss K, Koedam D, Kroiss J, Strohm E.南美挖蜂咽后腺的形态、化学和功能Trachypus boharti而且Trachypus elongatus.PLoS ONE。2013; 8: e82780。
Weiss K, Strohm E, Kaltenpoth M, Herzner G. Philanthinae(膜翅目,蟹蜂科)咽后腺的比较形态和抑菌雏窝保护机制的进化。中国生物医学工程学报。2015;15:1。
吴达克,李志强,李志强,李志强。挖掘蜂角质层碳氢化合物分布的多样性研究进展。进化。2017;71:2562 - 71。
Herzner G, Strohm E.用物理对抗真菌:孤独的黄蜂包裹食物防止水凝结。生物学报。2007;17:R46-47。
Herzner G, Strohm E.雌性欧洲蜂狼的食物包装,Philanthus三角座,可延缓幼虫供给量的水分流失。昆虫学报,2008;33:101-9。
Strohm E, Kaltenpoth M, Herzner G.独居掘地黄蜂的咽后腺是否与蚂蚁同源?来自化学和生理学的证据。中国生物工程学报,2010;
Bagnères AG, Morgan ED.咽后腺和蚁科的角质层含有相同的特征碳氢化合物。Experientia。1991;47:106-11。
沃尔什,彭蒂里,达托雷,林克斯韦尔。蚂蚁角质层碳氢化合物是可遗传的,并与菌落生产力的变化有关。Proc Roy Soc B. 2020; 277:20201029。
Martin SJ, Helanterä H, Drijfhout FP。寄生虫压力是蚂蚁化学线索多样性的驱动因素吗?Proc Roy Soc B. 2011; 278:496-503。
洛伦兹MC,阿扎尼L, Bagnéres A-G。欺骗的进化后果:群体签名的复杂性和信息含量受到社会寄生的青睐。Curr Zool. 2014; 60:137-48。
杨春华,张志刚,张志刚。植物抗旱性进化的生理机制黑腹果蝇.中国生物医学工程学报(英文版);2000;
吉布斯A,波莫尼斯JG。昆虫角质层碳氢化合物的物理性质:链长、甲基分支和不饱和的影响。《生物化学与物理学报》1995;
Rouault J-D, Marican C, Wicker-Thomas C, Jallon J-M。角质层碳氢化合物(HC)多态性与抗旱性及繁殖温度的关系HC演化模型d .腹而且d . simulans.遗传。2004;120:195 - 212。
Blomquist GJ。角质层碳氢化合物的生物合成。见:Blomquist GJ, Bagnères A-G,编辑。昆虫碳氢化合物:生物学,生物化学和化学生态学。剑桥:剑桥大学出版社;2010.35-52页。
Øien IJ, Moksnes A, Røskaft E.欧洲雀形目鸟蛋颜色和标记模式变异的进化:在与杜鹃的共同进化军备竞赛中的适应,Cuculus canorus.行为学学报,1995;6:166-74。
Kroiss J, Bordon S, Strohm E.一个孤独的掘地黄蜂的巢材料中的碳氢化合物代表一个专门的杜鹃黄蜂的kairomone。Anim Behav. 2008; 76:1555-63。
Carlson DA, Roan CS, Yost RA, Hector J.用于气相色谱/质谱的长链烯烃,碱二烯和碱二烯的二甲基二硫衍生物。肛交化学,1989;61:1564-71。
陈建平,陈建平。甲基支链烷烃的毛细管气相色谱分析。化学学报,1998;24:1845-65。
R核心团队。R:用于统计计算的语言和环境。R统计计算基础。奥地利维也纳,2013年。URLhttp://www.R-project.org/.
Kruskal简森-巴顿。优化非度量假设的拟合优度的多维尺度。心理测量学。1964;29:1-27。
Kruskal简森-巴顿。非度量多维尺度:一种数值方法。心理测量学。1964;29:115-29。
群落结构变化的非参数多元分析。《德国科学》1993;18:117-43。
当总体方差不相等时,两个均值之间的差异的显著性。生物统计学。1938;29:350 - 62。
鲁克斯顿GD。不平等方差t检验是学生t检验和曼-惠特尼U检验的一种未充分使用的替代方法。行为学学报,2006;17:688-90。
一个简单的顺序拒绝多重测试程序。杨晓明,杨晓明,杨晓明。
Oksanen J, Blanchet FG等。素食:社区生态包。R-package 2.0-10版本,2013年。
德雷S,杜福尔A-B。ade4包:为生态学家实现对偶图。中国统计杂志,2007;22:1-20。
潘伟华,李志强,李志强。R语言的系统发育和进化分析。生物信息学。2004;20:289 - 90。
Robinson M. Flagme:基于gcms的代谢组学数据的片段级分析。R包2013年1.14版。
瑞LJ。Phytools:一个R包,用于系统发育比较生物学(和其他东西)。方法生态环境学报,2012;3:217-23。
Smith CA, Want EJ, O 'Maille G, Abagyan R, Siuzdak G. XCMS:使用非线性峰比对、匹配和识别处理质谱数据进行代谢物分析。《肛肠化学》2006;78:779-87。
张志刚,张志刚,张志刚。膜翅目膜翅目单拷贝核基因的特异性引物分析。PLoS ONE。2012; 7: e39826。
Pauli T, Castillo-Cajas RF, Rosa P, Kukowka S, Berg A, van den Berghe E, Fornoff F, Hopfenmüller S, Niehuis M, Peters RS, Staab M, Strumia F, Tischendorf S, Schmitt T, Niehuis O.杜鹃黄蜂(膜翅目:金蜂科)的系统发育分析揭示了在属水平上的部分人工分类和一个种类丰富的拟寄生蜂分支。系统昆虫学报。2019;44:32 - 35。
Kearse M, Moir R, Wilson A, Stones-Havas S,张M, Sturrock S, Buxton S, Cooper A, Markowitz S, Duran C, Thierer T, Ashton B, Meintjes P, Drummond A. Geneious Basic:用于组织和分析序列数据的集成和可扩展的桌面软件平台。生物信息学。2012;28:1647-9。
Katoh K, Standley DM. MAFFT多序列比对软件版本7:性能和可用性的改进。中国生物医学杂志,2013;30:772-80。
王志强,王志强,王志强,王志强。ModelFinder:用于精确系统发育估计的快速模型选择。2017; 14:587-9。
阮丽婷,夏建平,王晓明。IQ-TREE:一种快速有效的估计最大似然系统发育的随机算法。中国生物医学杂志,2014;32:268-74。
Huelsenbeck JP, Ronquist F. MRBAYES:系统发生树的贝叶斯推断。生物信息学。2001;17:754-5。
Ronquist F, Huelsenbeck JP。MrBayes 3:混合模型下的贝叶斯系统发育推断。生物信息学。2003;19:1572-4。
李国强,李国强,李国强。示踪剂v1.6。可以从http://beast.bio.ed.ac.uk/Tracer, 2014年。
Alfken JD。德国西北部Verzeichnis der Goldwespen (Chrysiden)。不莱梅,1915;23:29 - 5。
伯兰·L,伯纳德·F. Hyménoptères vespiformes III。(鞘翅科,鞘翅科,三角帆科)。《法兰西牧神》第34卷。巴黎:Paul Lechevalier;1938.
Simon-Thomas RT, Simon-Thomas AMJ。对大熊猫雌性行为的一些观察Philanthus三角座(F.)(膜翅目,蜂科)。昆虫学报。1972;115:123-39。
明戈Pérez E.拉斯种españolas de Hedychrum LATR。, 1806年;,青蜂科).Eos。1981;55:143-54。
摩根·d·布谷鸟黄蜂。(膜翅目昆虫,青蜂科)。英国昆虫鉴定手册,第6卷。圣奥尔本斯:皇家昆虫学会;1984.
Veenendaal RL。Het verorgen ei vanHedychrum rutilans(膜翅目:青蜂科)。昆虫学报,1987;47:169-71。
贱人J,巴比尔Y,加尤博SF,施密特K,欧尔M。西方欧洲膜翅蜂科(卷2).法国农牧协会,82.巴黎:Fédération Française des Sociétés de Science Naturel;1997.
膜翅目:金蜂科:金蜂科。Bembix。1998;10:15-8。
van der Smissen J. Die Wildbienen and weespen schleswig - holstein - rote Liste。乐队》。弗林特贝克:州für石勒苏益格-荷尔斯泰因州的自然与环境;2001.
Reder G, Burger R. Nachweise der GoldwespeHedychrum chalybaeum(Dahlbom, 1854)在莱茵-普法尔茨(膜翅目:金蜂科)。莱茵-普法尔茨区动物群。2009; 11:851-6。
Paukkunen J, Berg A, Soon V, Ødegaard F, Rosa P.北欧和波罗的海国家布谷鸟黄蜂(膜翅目,金翅科)的插图关键,与一个新种的描述。ZooKeys。2015; 548:1 - 116。
王晓燕,王晓燕,王晓燕,王晓燕。生物学报,Lebensräume, Artenporträts。斯图加特:Eugen Ulmer Verlag;2020.
确认
不适用。
资金
由Projekt DEAL启动和组织的开放获取资金。本出版物由Würzburg大学的开放获取出版基金支持。O.N.和T.S.感谢德国研究基金会(DFG)对本研究的支持(NI1387/1-1;NI1387/5-1;SCHM 2645/1-1;SCHM 2645/2-1)。R.C.承认德国学术交流服务机构(DAAD)提供奖学金以完成她的博士学位。该研究也得到了Ministerio de Economía, Industria y Competitividad (España)在项目CGL2017- 83046-P(给C.P.和T.S.)中的支持。
作者信息
作者及隶属关系
贡献
ON和TS构思并设计了该项目。CP和RC参与了项目的开发。CP、MW、ON、RC、TS采集样品。MW和RC进行了化学分析。RC和TP进行分子分析。AK、HF、ON、RC对数据进行统计分析。RC写了手稿的初稿。ON和TS对手稿进行了改进和修改。所有作者都阅读并批准了手稿的最终版本。
相应的作者
道德声明
伦理批准并同意参与
不适用。
发表同意书
不适用。
相互竞争的利益
作者声明没有利益竞争。
额外的信息
出版商的注意
施普林格自然对出版的地图和机构从属关系中的管辖权主张保持中立。
补充信息
附加文件1:图S1。
膜翅目捕食蜂(HYMw)和鞘翅目捕食蜂(COLw)蜂体中a) CHC化合物总量和b)甲基支链烷烃数量及c)甲基支链烷烃比例的箱状图Hedychrum本研究中的物种。女性用深灰色描绘,男性用浅灰色描绘。图S2。a)所有寄主物种的雌性和b)雄性个体角质层碳氢化合物剖面的种内和种间变异。计算捕猎同一类型猎物的所有物种个体之间(“物种间”)和同一物种个体之间(注明物种名称)的布雷-柯蒂斯差异。然而,在这种情况下,与文中所示的图相比,每组最多只随机选择了5个个体,因此每组使用的标本数量保持不变(5)。图S3。从属于HYMw或COLw的物种的同一种群中收集的两个随机选择的CHC剖面样本之间的Bray-Curtis差异(a)和雄性(b)。在每种情况下,来自同一物种的两个个体之间的成对距离是在1000次模拟中随机选择的。
附加文件2:表S1。
用于分析的所有标本的来源和收集和储存的细节。表S2。用于系统发育分析的核基因外显子区的引物特征和核苷酸数量。分号前的数字表示外显子区数量,分号后的数字表示每个基因使用的核苷酸总数。表S3。由Modelfinder选择的替代模型分别用于IQTree和MrBayes的系统发育分析。表S4。所分析的所有物种雌性NMDS中每个峰或混合峰的平均相对丰度±标准差。表S5。所分析的所有物种雄性NMDS中每个峰或混合峰的平均相对丰度±标准差。表S6。图中用于分子系统发育的基因的接入号。1.表S7。所有样品的CHC化合物的相对组成。第一行显示使用复合名称缩写的留存指数。第一列显示标本的名称、性别和编号
权利和权限
开放获取本文遵循知识共享署名4.0国际许可协议,允许以任何媒介或格式使用、分享、改编、分发和复制,只要您对原作者和来源给予适当的署名,提供知识共享许可协议的链接,并注明是否有更改。本文中的图像或其他第三方材料包含在文章的创作共用许可协议中,除非在材料的信用额度中另有说明。如果材料未包含在文章的创作共用许可协议中,并且您的预期使用不被法定法规所允许或超出了允许的使用范围,您将需要直接获得版权所有者的许可。如欲查看本牌照的副本,请浏览http://creativecommons.org/licenses/by/4.0/.创作共用公共领域奉献弃权书(http://creativecommons.org/publicdomain/zero/1.0/)适用于本条所提供的资料,除非在资料的信用额度中另有说明。
关于本文
引用本文
Castillo, R., Wurdack, M., Pauli, T.。et al。杜鹃属黄蜂之间进行化学军备竞赛的证据Hedychrum以及它们的远亲宿主类蜂。BMC eco Evo22138(2022)。https://doi.org/10.1186/s12862-022-02093-8
收到了:
接受:
发表:
DOI:https://doi.org/10.1186/s12862-022-02093-8
关键字
- 化学模仿
- 青蜂科
- 表皮碳氢化合物
- 进化军备竞赛
- 膜翅目昆虫
- Philanthidae